 |
 |
 |
 |
.jpg) Наиболее важны с токсикологической точки зрения сульфат магния и хлорид (глюконат) кальция. Сульфат магния при парентеральном применении оказывает выраженное седативное действие на центральную нервную систему, в связи с чем используется как успокаивающее и противосудорожное средство. При введении внутрь препарат действует как слабительное и желчегонное средство, что связано с рефлексами, возникающими с интерорецепторов различных отделов пищеварительного аппарата.
Наиболее важны с токсикологической точки зрения сульфат магния и хлорид (глюконат) кальция. Сульфат магния при парентеральном применении оказывает выраженное седативное действие на центральную нервную систему, в связи с чем используется как успокаивающее и противосудорожное средство. При введении внутрь препарат действует как слабительное и желчегонное средство, что связано с рефлексами, возникающими с интерорецепторов различных отделов пищеварительного аппарата.
Патогенез и симптомы отравления сульфатом магния. Отравление сульфатом магния может наступить вследствие передозировки препарата при парентеральном (особенно внутривенном) его применении. Опасность отравления становится особенно реальной, если нарушена выделительная функция почек. При этом возникает состояние наркоза, быстро приводящее (ввиду малой широты наркотического действия) к угнетению и параличу дыхательного центра. В патогенезе отравления существенно также курареподобное действие сульфата магния, распространяющееся в случае применения токсических доз и на дыхательную мускулатуру. Антагонистом иона магния является ион кальция, поэтому при остром отравлении сульфатом магния в качестве физиологического антидота используется хлорид (или глюконат) кальция.
Если токсические дозы сульфата магния приняты внутрь, возникают рвота, боль в животе, понос с примесью крови. При любом пути введения наблюдаются вначале беспокойство, покраснение лица, затем общий упадок сил, сонливость, брадикардия, быстрое снижение артериального давления, поверхностное и неправильное дыхание, вплоть до полного его прекращения.
Первая помощь и лечение при отравлении сульфатом магния. При появлении первых признаков передозировки следует ввести медленно в вену 10 мл 10% раствора хлорида или глюконата кальция, при необходимости эту же дозу вводят повторно. В результате ослабляется наркотический эффект и восстанавливается дыхание. Курареподобное действие сульфата магния купируется внутривенным введением 1 мл 0,05% раствора про-зерина. При нормальной функции почек вводят парентерально 1—2л изотонического раствора хлорида натрия, 5% раствора глюкозы. В случае остановки дыхания проводят реанимационные мероприятия (см. с. 33).
Хлорид и глюконат кальция применяются как десенсибилизирующие (антиаллергические) средства. Эти свойства широко используются при аллергических заболеваниях, состояниях (сывороточной болезни, крапивнице, ангионевротическом отеке и др.) и осложнениях, связанных с аллергизацией вследствие применения химических средств (лекарств, ядохимикатов), в том числе и при острых отравлениях последними.
Симптомы отравления и помощь при отравлении хлоридом и глюконатом кальция. При внутривенном введении токсических доз хлорида кальция отмечаются снижение артериального давления, угнетение сердечной деятельности и дыхания. Средств антидотной терапии не существует, проводится симптоматическая терапия стимуляторами кровообращения и дыхания (кофеин-бензоат натрия, камфора).
При попадании под кожу хлорид кальция вызывает раздражение и некроз тканей. Поэтому следует немедленно отсосать при помощи шприца попавший под кожу раствор и ввести в это место (через ту же иглу) 10 мл 25% раствора сульфата натрия, образующего при взаимодействии с хлоридом кальция нерастворимый сульфат кальция (гипс).
Лечение острых отравлений, 1982 г.
Еще статьи об острых отравлениях:
Антидоты – лекарственные препараты, применяемые для лечения при отравлениях. При этом образуются менее- или нетоксичные осадки или комплексные соединения.
а) 5-10% водный раствор кальция хлорида назначают при попадании в организм щавелевой кислоты или ее солей, а также фторид-ионов :
б) при отравлении растворимыми солями бария или свинца желудок промывают 1% раствором сульфата магния :
Решение задач.
Алгоритм составления выражения для KS.
а) для солей из двух ионов KtAn; KtAn ↔ Kt + + An – : KS = [Kt + ] · [ An – ] = х 2 ;
б) для солей из трех ионов KtAn2; KtAn2 ↔ Kt 2+ + 2An – : KS = [ Kt 2+ ] · [ An – ] 2 = х · ( 2х) 2 = 4 х 3
аналогично для Kt2An;
в) для солей из четырех ионов KtAn3: KtAn3 ↔ Kt 2+ + 3An – : KS = х · ( 3х) 3 = 27х 4
аналогично для Kt3An;
г) для солей из пяти ионов Kt2An3: Kt2An3 ↔ 2Kt 2+ + 3An – : KS = ( 2х) 2 · ( 3х) 3 = 108 х 5
Вычисление растворимости по константе растворимости.
1. Выразить растворимость через Х моль/л.
2. Написать уравнение диссоциации малорастворимого сильного электролита. Определить концентрации ионов в растворе по уравнению.
3. Записать формулу для константы растворимости данного малорастворимого сильного электролита.
4. В формулу для KS подставить значения концентрации ионов.
5. Выразить из этой формулы значение для Х (растворимость в моль/л).
6. Вычислить значение растворимости в моль/л и в г/л.
Задача 1. Произведение растворимости равно 1,0 . 10 -97 . Вычислите растворимость сульфида висмута в молях и в граммах на литр насыщенного раствора.
| Дано: KS (Bi2S3) = 1,0 . 10 -97 ————————- S (Bi2S3) -? | Решение: 1). Пусть растворимость равна Х моль/л. 2). Для сульфида висмута (III) |
| х 2х 3х Bi2S3 ó 2Bi 3+ + 3S 2- тв.соль ионы в растворе |
3). KS = [Bi 3+ ] 2 · [S 2- ] 3
4). KS = (2х) 2 · (3х) 3 = 108х 5 , 5). х =. 
6) х =  = 1,56 · 10 -20 . S (Bi2S3) = 1,56 · 10 -20 моль/л.
= 1,56 · 10 -20 . S (Bi2S3) = 1,56 · 10 -20 моль/л.
М (Bi2S3) = 691 г/моль. S (Bi2S3) = 1,56 · 10 -20 х 691 = 1,1 · 10 -17 г/л.
Вычисление константы растворимости по растворимости вещества.
1. Выразить растворимость в моль/л, если по условию она приведена в других единицах.
2. Написать уравнение диссоциации малорастворимого сильного электролита. Выразить растворимость через Х моль/л. Определить концентрации ионов в растворе по уравнению.
3. Записать формулу для константы растворимости данного малорастворимого сильного электролита.
4. Подставить в формулу для KS значения концентраций ионов, выраженные через Х.
5. Вычислить значение константы растворимости.
Задача 2. В 1000 мл насыщенного водного раствора, полученного при 25 0 С, содержится 8,8 . 10 -7 г бромида серебра. Вычислите произведение растворимости бромида серебра.
| Дано: S (AgBr) = 8,8 . 10 -7 г ————————- KS (AgBr) -? | Решение: 1).  |
| 2) х х х AgBr ↔ Ag + + Br – тв.соль ионы в растворе |
3). KS = [Ag + ] · [Br – ] 4). KS = х · х = х 2 5) KS = (4,7 · 10 -9 ) 2 = 2,2 · 10 -17 .
Образование осадков.
1. Вычислить концентрацию веществ в первый момент после смешивания, т.к. при смешивании общий объем раствора увеличивается, соответственно изменяется концентрация.
2. Вычислить концентрации ионов, образующих сильный малорастворимый электролит, после смешивания.
3. Написать уравнение диссоциации малорастворимого сильного электролита. Записать формулу для константы растворимости данного малорастворимого сильного электролита.
4. Вычислить значение Пс – реальное произведение ионов. Формула для Пс соответствует формуле для KS. Подставить в формулу значения концентраций ионов.
5. Сравнить значения KS и Пс. Если:
Пс > KS – пересыщенный раствор, осадок выпадает,
Пс -3 моль/л и 50 мл фосфата натрия с молярной концентрацией 4,0 ∙ 10 -3 моль/л. Ks (Ca3 (PO4)2) = 2,0 ∙ 10 -29 .
Решение.
1. В первый момент после смешивании общий объем увеличивается (Vcмеси=0,1+0,05=0,15л), а концентрации уменьшаются:
 ; С (CaCl2) =
; С (CaCl2) =  = 0,004 моль/л = 4,0 ∙ 10 -3 моль/л;
= 0,004 моль/л = 4,0 ∙ 10 -3 моль/л;
С (Na3PO4) = 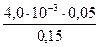 = 0,0013 моль/л = 1,33 ∙ 10 -3 моль/л.
= 0,0013 моль/л = 1,33 ∙ 10 -3 моль/л.
2. Малорастворимый электролит – фосфат кальция.
С (Ca 2+ ) = 4,0 ∙ 10 -3 моль/л, С(PO4 3+ ) = 1,33 ∙ 10 -3 моль/л
тв.соль ионы в растворе
4. Пс = (4,0 ∙ 10 -3 ) 3 ∙ (1,33 ∙ 10 -3 ) 2 = 1,14 ∙ 10 -13 .
5. Пс > KS – пересыщенный раствор, осадок выпадает
Задача 4. Образуется ли осадок при смешивании равных объемов хлорида кальция с молярной концентрацией 2,0 ∙ 10 -6 моль/л и фосфата натрия с молярной концентрацией 1,0 ∙ 10 -6 моль/л. Ks (Ca3 (PO4)2) = 2,0 ∙ 10 -29 .
Решение.
1. При смешивании равных объемов общий объем увеличивается в два раза, а концентрации уменьшаются в два раза. С (CaCl2) = 1,0 ∙ 10 -6 моль/л, С (Na3PO4) = 5,0 ∙ 10 -7 моль/л.
2. Малорастворимый электролит – фосфат кальция.
С (Ca 2+ ) = 1,0 ∙ 10 -6 моль/л, С(PO4 3- ) = 5,0 ∙ 10 -7 моль/л
тв.соль ионы в растворе
4. Пс = С(Ca 2+ ) 3 · С(PO4 3- ) 2 = (1,0 ∙ 10 -6 ) 3 ∙ (5,0 ∙ 10 -7 ) 2 = 2,5 ∙ 10 -31

Папиллярные узоры пальцев рук – маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.



Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Фармакологическое действие
Кальций – макроэлемент, участвующий в формировании костной ткани, процессе свертывания крови, необходим для поддержания стабильной сердечной деятельности, процессов передачи нервных импульсов. Улучшает сокращение мышц при мышечной дистрофии, миастении, уменьшает проницаемость сосудов. При в/в введении кальций вызывает возбуждение симпатической нервной системы и усиление выделения надпочечниками адреналина; оказывает умеренное диуретическое действие.
При взаимодействии раствора кальция хлорида с солями магния, щавелевой и фтористой кислотами образуются нерастворимые соединения, что позволяет применять раствор кальция хлорида в качестве антидота.
