Содержание:
Опасна, но необходима. Соляная кислота – составная желудочного сока . Именно он помогает переваривать пищу. В норме, кислоты в желудке 0,3%.
Этого достаточно, чтобы разрушить бритвенное лезвие. Нужно всего около недели. Эксперименты, конечно, проводили вне человеческого тела.

Опасный предмет повредил бы пищевод, не задержался бы в желудке в течение 7-ми дней.
Какие еще эксперименты ставили ученые и чем пополнили список свойств соляной кислоты, расскажем далее.
Свойства соляной кислоты
Формула соляной кислоты – это смесь воды и хлористого водорода. Соответственно, жидкость едкая, что и позволяет ей разрушать большинство веществ.
На вид реагент бесцветный. Выдает его запах. Он кислый, удушливый. Аромат резкий и, скорее, характеризуется, как вонь.
Если раствор соляной кислоты технический, в нем содержатся примеси двухатомного хлора и железа . Они придают жидкости желтоватый оттенок.
В отличии, к примеру, от серной , масса соляной кислоты в растворе не может превышать 38%.
Это критическая точка, при которой вещество попросту испаряется. Улетучивается и хлороводород, и вода.
При этом, естественно, раствор дымится. Максимальная концентрация указана для 20-градусной температуры воздуха. Чем больше градусов, тем быстрее протекает испарение.
Плотность 38-процентной кислоты чуть превышает 1 грамм на кубический сантиметр.

То есть, даже концентрированное вещество весьма водянисто. Хлебнешь такую жидкость, получишь ожоги.
А вот слабый 0,4-процентный раствор можно выпить. Естественно, в небольших количествах. Разбавленная кислота почти не пахнет, а вкус у нее терпко-кислый.
Взаимодействие соляной кислоты с другими веществами, во многом, обосновано одноосновным составом реагента.
Это значит, что в формулу кислоты входит лишь один атом водорода. Значит, в воде реагент диссоциирует, то есть, растворяется, полностью.
Остальные вещества, как правило, растворяются уже в самой кислоте. Так, в ней распадаются все металлы, стоящие в периодической системе перед водородом.
Растворяясь в кислоте, они связываются с хлором. В итоге, получаются хлориды, то есть, соли .
Реакция с соляной кислотой состоится у большинства оксидов и гидроксидов металлов, а так же у их солей .
Главное, чтобы последние были получены от более слабых кислот. Соляная считается одной из самых сильных, ставится в один ряд с серной.
Из газов соляная кислота бурно реагирует с аммиаком. При этом, образуется хлорид аммония. Он кристаллизуется.
Частицы столь мелкие, а реакция столь активна, что хлорид устремляется вверх. Внешне это белый дым.
Белым является и продукт реакции с нитратом серебра . Это взаимодействие относится к качественно определяющим соляную кислоту .
Итог реакции – творожистый осадок. Это хлорид серебра . В отличие от хлорида аммония, он устремляется вниз, а не вверх.

Реакция с нитратом серебра считается качественной, поскольку является специфической, не свойственной остальным однокомпонентным кислотам.
Они игнорируют благородные металлы, к коим относится и аргентум. Как помните, серебро стоит в химическом ряду после водорода и, по идее, не должно взаимодействовать с растворенным в воде хлороводородом.
Добыча соляной кислоты
Выделяется соляная кислота не только в лабораторных условиях, но и природе. Человеческий организм – ее часть.
Но, соляная кислота в желудке уже обсуждалась. Однако, это не единственный природный источник, причем, в прямом смысле.
Реагент встречается в некоторых гейзерах и прочих выходах воды вулканического происхождения.
Что же касается отдельно хлороводорода, он входит в состав бишофита, сильвина, галита. Все это – минералы.
Под словом «галит» скрывается обычная соль, которую употребляют в пищу, то есть, хлорид натрия.
Сильвин – это хлорид калия , его кристаллы по форме напоминают игральные кости. Бишофит – хлорид магния , в изобилии присутствует на землях Поволжья.
Для промышленного получения реагента подходят все перечисленные минералы.
Но, чаще всего используют хлорид натрия. Соляная кислота получается, когда на поваренную соль воздействуют концентрированной серной кислотой.
Суть метода сводится к растворению газообразного хлороводорода в воде. На этом основаны еще два подхода.
Первый – синтетический. Водород сжигают в хлоре. Второй – абгазный, то есть, попутный.
Используется хлороводород, попутно получаемый при работе с органическими соединениями, то есть, углеводородами.
Абгазный хлороводород образуется при дегидрохлорировании и хлорировании органики.
Вещество, так же, синтезируется при пиролизе хлорорганических отходов. Пиролизом химики именуют разложение углеводородов в условиях дефицита кислорода.
Попутным сырье для соляной кислоты бывает и при работе с неорганическими веществами, к примеру, хлоридами металлов.

Тот же сильвин, к примеру, идет на производство калиевых удобрений. Магний тоже нужен растениям.
Поэтому, без дела не остается и бишофит. В итоге, производят не только подкормки, но и соляную кислоту.
Абгазный метод вытесняет остальные способы получения соляной кислоты. На «побочную» индустрию приходятся 90% производимого реагента. Узнаем, зачем его изготовляют, где применяют.
Применение соляной кислоты
Соляная кислота используется металлургами. Реагент нужен для декапирования металлов.
Так называют процесс удаления окалин, ржавчины, окислов и просто грязи. Соответственно, кислоту применяют и частные мастера, работая, к примеру, с винтажными вещами, в коих есть металлические детали.
Реагент растворит их поверхность. От проблемного слоя не останется и следа. Но, вернемся к металлургии.
В этой отрасли кислоту начинают применять для извлечения из руд редких металлов.
Старые методы основаны на использовании их оксидов. Но, не все из них легки в обработке.
Поэтому, окислы стали переводить в хлориды, а после, восстанавливать. Сейчас, так получают, к примеру, титан и цирконий .
Раз соляная кислота содержится в желудочном соке, а раствор малой концентрации можно выпить, значит, реагент можно применять и в пищевой промышленности.
Увидели на упаковке продукта добавку Е507? Знайте, это соляная кислота. Она придает ту самую кислинку и терпкость некоторым пирожным, колбасам.
Но, наиболее часто пищевой эмульгатор добавляют во фруктозу, желатин и лимонную кислоту.
Е507 нужна не только для вкуса, но и в качестве регулятора кислотности, то есть Ph продукта.

Соляная кислота может применяться в медицине. Слабый раствор соляной кислоты прописывают пациентам с пониженной кислотность желудка.
Она не менее опасна, чем повышенная. В частности, увеличивается вероятность рака желудка.
Организм недополучает полезные элементы, даже, если человек принимает витамины и правильно питается.
Дело в том, что для адекватного, полноценного всасывания полезных веществ, нужна стандартная кислотность.
Последнее применение реагента очевидно. Из кислоты получают хлор. Достаточно выпарить раствор.
Хлор идет на очищение питьевой воды, отбеливание тканей, обеззараживание, производство пластикатов и каучука .
Получается, будучи активной и агрессивной, соляная кислота необходима человечеству. Есть спрос, — есть предложение. Узнаем цену вопроса.
Цена соляной кислоты
Цена продукта зависит от вида. Техническая кислота дешевле, очищенная – дороже. За литр первой просят 20-40 рублей.
Стоимость зависит от концентрации. За литр очищенного реагента дают примерно на 20 рублей дороже.
Ценник зависит и от тары, фасовки, формы продажи. Приобретение кислоты в пластиковых канистрах по 25-40 литров выгоднее.
В медицинской же сфере, в рознице, вещество предлагают в стеклянных бутыльках .
За 50 миллилитров отдашь 100-160 рублей. Это самая дорогостоящая соляная кислота.
Купить раствор хлороводорода в литровой таре тоже не дешево. Фасовка рассчитана на частного потребителя, поэтому, за бутыль просят около 400-500 рублей.

Техническая кислота в рознице встречается реже, стоит примерно на 100 рублей дешевле. Основной же рынок – оптовый.
Закупаются крупные предприятия. Именно для них актуальны цены, обозначенные в начале главы. В розницу гиганты рынка не торгуют.
Соответственно, стоимость вещества в небольших магазинах – отражение «аппетитов» владельцев лавок.
Кстати, об аппетите. Если кислотность в желудке повышена, пища переваривается быстрее, чаще хочется есть.
Это приводит к худобе, гастриту и язвам. Люди же с пониженной кислотностью склонны к зашлакованности, ведь пища долго «бродит» в желудке, плохо усваивается.
Это отражается на коже, как правило, в виде акне и черных точек. Есть такая проблема?
Задумайтесь не о дорогой косметике, а о проверке желудочно-кишечного тракта.
| Соляная кислота | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Хлороводородная кислота |
| Хим. формула | H₂O:HCl |
| Рац. формула | HCl |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 36.46 г/моль |
| Плотность | 1.19 г/см³ |
| Термические свойства | |
| Т. плав. | -30 °C |
| Т. кип. | 48 °C |
| Энтальпия образования | -605.22 кДж/моль |
| Химические свойства | |
| pKa | -10 |
| Растворимость в воде | смешивается |
| Классификация | |
| Рег. номер CAS | 7647-01-0 |
| Рег. номер EINECS | 933-977-5 |
| Кодекс Алиментариус | E507 |
| RTECS | MW4025000 |
| Безопасность | |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Соли соляной кислоты называются хлоридами.
Содержание
История [ править | править код ]
Впервые хлороводород получил алхимик Василий Валентин, нагрев гептагидрат сульфата железа с поваренной солью и назвав полученное вещество «духом соли» (лат. spiritus salis ). Иоганн Глаубер в XVII в. получил соляную кислоту из поваренной соли и серной кислоты. В 1790 году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав. Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия: на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород. В 1863 году в Англии был принят закон «Alkali Act», согласно которому запрещалось выбрасывать этот хлороводород в воздух, а необходимо было пропускать его в воду. Это привело к развитию промышленного производства соляной кислоты. Дальнейшее развитие произошло благодаря промышленным методам получения гидроксида натрия и хлора путём электролиза растворов хлорида натрия [1] .
Физические свойства [ править | править код ]
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), мас. % | Конц. (г/л), кг HCl/м³ |
Плотность, кг/л |
Молярность, M |
Водородный показатель (pH) |
Вязкость, мПа·с |
Удельная теплоемкость, кДж/(кг·К) |
Давление пара, Па |
Т. кип., °C |
Т. пл., °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)
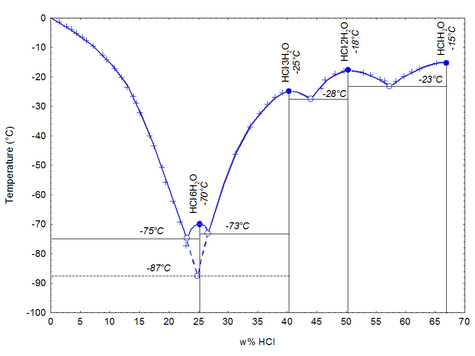
При низкой температуре хлороводород с водой даёт кристаллогидраты составов HCl·H2O (т. пл. –15,4 °С), HCl·2H2O (т. пл. –18 °С), HCl·3H2O (т. пл. –25 °С), HCl·6H2O (т. пл. –70 °С). При атмосферном давлении (101,3 кПа) хлороводород с водой образуют азеотропную смесь с т. кип. 108,6 °С и содержанием HCl 20,4 мас. % [2] .
Химические свойства [ править | править код ]
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
2 N a + 2 H C l ⟶ 2 N a C l + H 2 ↑ <displaystyle <mathsf <2Na+2 HCllongrightarrow 2 NaCl+ H_<2>uparrow >>>

- Взаимодействие с оксидамиметаллов с образованием растворимой соли и воды:
N a 2 O + 2 H C l ⟶ 2 N a C l + H 2 O <displaystyle <mathsf <2>O+2 HCllongrightarrow 2 NaCl+ H_<2>O>>>

- Взаимодействие с гидроксидамиметаллов с образованием растворимой соли и воды(реакция нейтрализации):
N a O H + H C l ⟶ N a C l + H 2 O <displaystyle <mathsf <2>O>>>

- Взаимодействие с солямиметаллов, образованных более слабыми кислотами, например угольной:
N a 2 C O 3 + 2 H C l ⟶ 2 N a C l + H 2 O + C O 2 ↑ <displaystyle <mathsf <2>CO_<3>+2 HCllongrightarrow 2 NaCl+ H_<2>O+ CO_<2>uparrow >>>
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
2 K M n O 4 + 16 H C l ⟶ 5 C l 2 ↑ + 2 M n C l 2 + 2 K C l + 8 H 2 O <displaystyle <mathsf <2KMnO_<4>+16 HCllongrightarrow 5 Cl_<2>uparrow +2 MnCl_<2>+2 KCl+8 H_<2>O>>>
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте[4] :
H C l + A g N O 3 → A g C l ↓ + H N O 3
ightarrow AgCl
Получение [ править | править код ]
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
N a C l + H 2 S O 4 → 150 o C N a H S O 4 + H C l <2>SO_<4> При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие: 2 N a C l + H 2 S O 4 → 550 o C N a 2 S O 4 + 2 H C l <2>SO_<4> Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль): M g C l 2 ⋅ 6 H 2 O → t , o C M g O + 2 H C l + 5 H 2 O <2>cdot 6H_<2>O Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например: 2 M g C l 2 + H 2 O → M g 2 O C l 2 + 2 H C l <2>+H_<2>O Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту. Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды. При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека. В РФ оборот соляной кислоты концентрации 15 % и более — ограничен [6] . Соляная кислота (хлористоводородная кислота) – водный раствор хлористого водорода HCl, представляет собой прозрачную бесцветную жидкость с острым запахом хлористого водорода. Техническая кислота имеет желтовато-зеленый цвет из-за примесей хлора и солей железа. Максимальная концентрация соляной кислоты около 36% HCl; такой раствор имеет плотность 1,18 г/см3. Концентрированная кислота на воздухе “дымит”, так как выделяющийся газообразный HCl образует с водяным паром мельчайшие капельки соляной кислоты. Соляная кислота не горюча, не взрывоопасна. Она является одной из самых сильных кислот, растворяет (с выделением водорода и образованием солей – хлоридов) все металлы, стоящие в ряду напряжений до водорода. Хлориды образуются и при взаимодействии соляной кислоты с окислами и гидроокисями металлов. С сильными окислителями она ведет себя как восстановитель. Соли соляной кислоты – хлориды, за исключением AgCl, Hg2Cl2, хорошо растворимы в воде. К ней устойчивы стекло, керамика, фарфор, графит, фторопласт. Получают соляную кислоту растворением в воде хлористого водорода, который синтезируют или непосредственно из водорода и хлора или получают действием серной кислоты на хлорид натрия. Выпускаемая техническая соляная кислота имеет крепость не менее 31% HCl (синтетическая) и 27,5% HCl (из NaCI). Торговую кислоту называют концентрированной, если она содержит 24% и больше HCl, если содержание HCl меньше, то кислота называется разбавленной. Соляную кислоту применяют для получения хлоридов различных металлов, органических полупродуктов и синтетических красителей, уксусной кислоты, активированного угля, различных клеев, гидролизного спирта, в гальванопластике. Ее применяют для травления металлов, для очистки различных сосудов, обсадных труб буровых скважин от карбонатов, окислов и др. осадков и загрязнений. В металлургии кислотой обрабатывают руды, в кожевенной промышленности – кожу перед дублением и крашением. Соляную кислоту применяют в текстильной, пищевой промышленности, в медицине и т. д. Соляная кислота играет важную роль в процессах пищеварения, она является составной частью желудочного сока. Разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока. Транспортируют соляную кислоту в стеклянных бутылях или гуммированных (покрытых слоем резины) металлических сосудах, а также в полиэтиленовой посуде. Соляная кислота очень опасна для здоровья человека. При попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При попадании соляной кислоты на кожные покрытия ее необходимо немедленно смыть обильной струей воды. Очень опасны туман и пары хлороводорода, образующиеся при взаимодействии с воздухом концентрированной кислоты. Они раздражают слизистые оболочки и дыхательные пути. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, помутнение роговицы глаз, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. В случае утечки или разлива соляная кислота может нанести существенный ущерб окружающей среде. Во-первых, это приводит к выделению паров вещества в атмосферный воздух в количествах превышающих санитарно-гигиенические нормативы, что может повлечь отравление всего живого, а также появлению кислотных осадков, которые могут привести к изменению химических свойств почвы и воды. Во-вторых, она может просочиться в грунтовые воды, в результате чего может произойти загрязнение внутренних вод. В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур. При попадании на металлы соляная кислота вызывает их коррозию, а, реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор. В случае разлива соляную кислоту смывают с поверхностей большим количеством воды или щелочного раствора, который нейтрализует кислоту. Материал подготовлен на основе информации открытых источников “>

Применение [ править | править код ]

Промышленность [ править | править код ]
Медицина [ править | править код ]
Особенности обращения [ править | править код ]

Острое отравление сопровождается охриплостью голоса, удушьем, насморком, кашлем.
Там, где вода в реках и озерах стала довольно кислой (рН менее 5) исчезает рыба. При нарушении трофических цепей сокращается число видов водных животных, водорослей и бактерий.